除强化食品外,植物油被认为是植物甾醇最丰富的来源之一
植物甾醇是以环戊烷-α-菲环为基本结构单元的甾体醇类化合物,目前文献报道发现超过250种植物甾醇。
植物甾醇可分为两类,一类是根据C-3位置上-OH是否结合其他化学结构分为游离甾醇(FS)和结合甾醇。
另一类是根据C-4位置上甲基的数量可分为4-无甲基甾醇、4-单甲基甾醇和4,4-二甲基甾醇。
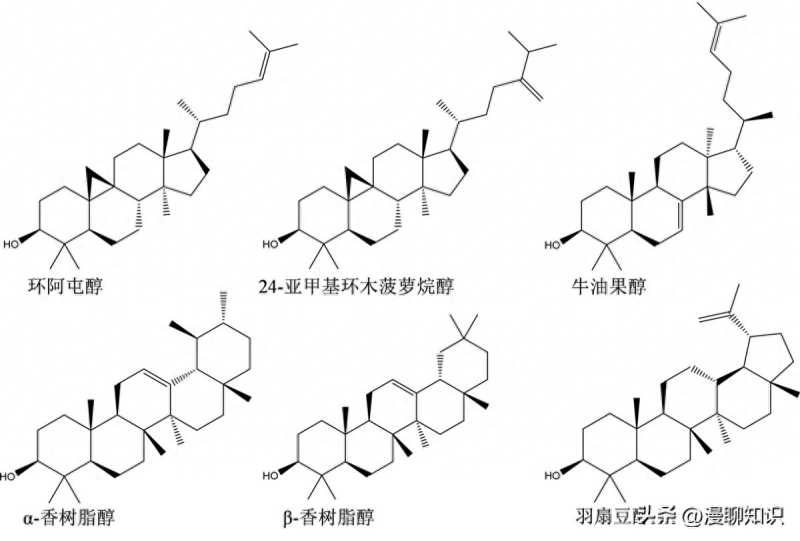
因此,4,4-二甲基甾醇是指C-4位置含有两个甲基的植物甾醇,也称为三萜醇。
4,4-二甲基甾醇根据结构差异可进一步分为四环三萜醇和五环三萜醇两大类。
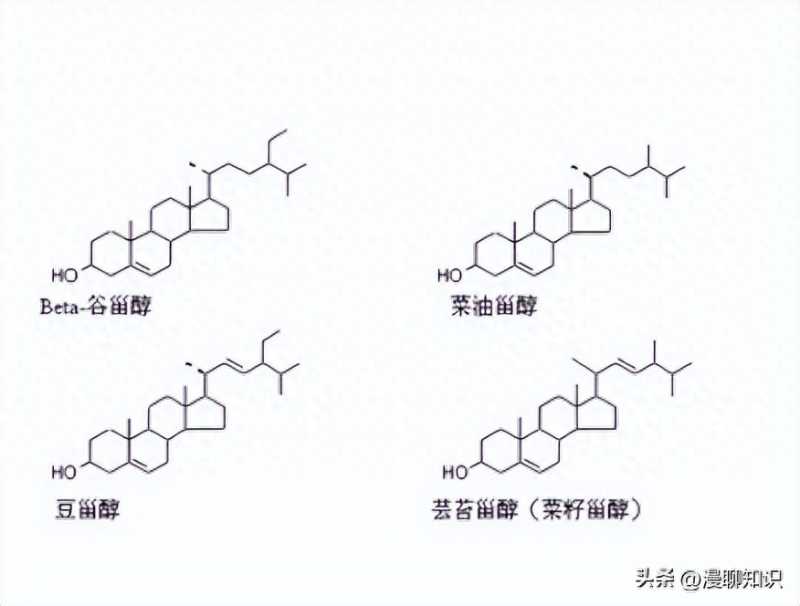
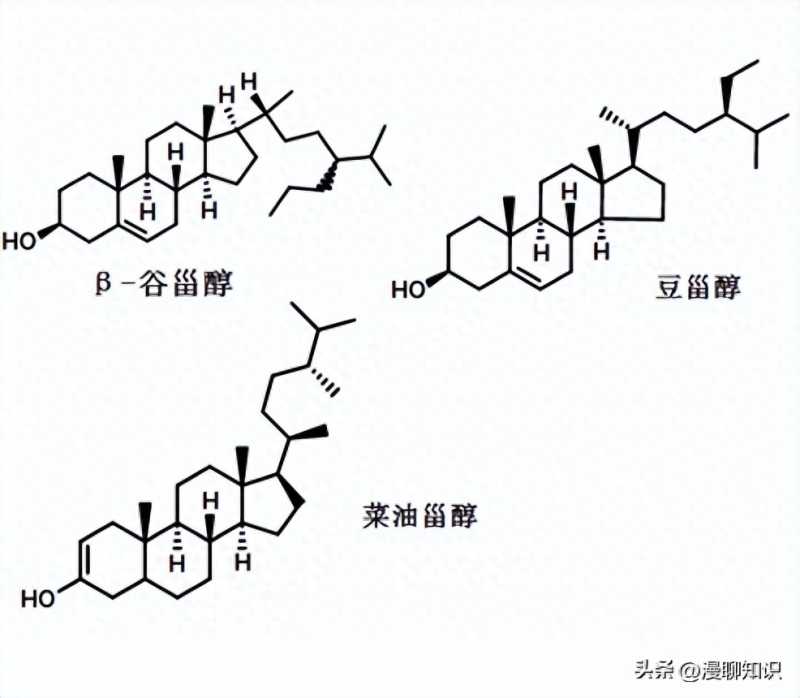
目前,植物甾醇在很多研究中主要指4-无甲基甾醇,如2010年卫生部批准的新资源食品中的植物甾醇是指β-谷甾醇、菜油甾醇和豆甾醇,均为4-无甲基甾醇。
4-无甲基甾醇最显著的生物活性为降胆固醇,具体表现为降低总胆固醇(TC)和低密度脂蛋白胆固醇(LDL-C),是植物甾醇一直以来最主要的研究内容之一,主要是因为4-无甲基甾醇的化学结构与胆固醇相似,提供更多的机会与胆固醇竞争进入混合胶束,这也是4-无甲基甾醇降低血液胆固醇作用机制之一。
4,4-二甲基甾醇主要包括环阿屯醇、24-亚甲基环木菠萝烷醇、α-香树脂醇、β-香树脂醇、羽扇豆醇和牛油果醇。
而无论来自乳木果油还是米糠油的4,4-二甲基甾醇都无法显著降低TC和LDL-C,对4,4-二甲基甾醇的研究相对较少。
但随着研究的不断深入,4,4-二甲基甾醇生物活性成为新的研究热点,本文主要围绕4,4-二甲基甾醇生物活性展开。

除强化食品外,一般来说,植物油被认为是植物甾醇最丰富的来源之一,植物甾醇是植物油不皂化物的主要成分,约占植物油的1%。
植物油中4,4-二甲基甾醇含量在12.0 ~ 260.0 mg/100 g之间,以米糠油含量最高,随后是坚果和谷物,坚果中4,4-二甲基甾醇含量为0.4 ~ 8.2 mg/100 g,占总甾醇含量的2.5 ~ 17.1%,谷物中大米制品的4,4-二甲基甾醇含量约为30.0 mg/100 g,与β-谷甾醇含量基本相当,而在小麦制品和其他谷物中,其含量为小于5 mg/100 g,豆科植物中4,4-二甲基甾醇含量为24.3 ~ 38.8 mg/100 g,豆制品中为2.0 ~ 9.7 mg/100 g,蔬菜和水果中4,4-二甲基甾醇含量较低。

常见的脂质提取方法也适用于植物甾醇的提取。
非极性溶剂,如己烷或石油醚,可有效地提取FS,SE和HSE,而有效地提取SG或ASG需要更多的极性溶剂,如热乙醇或丙酮,但随着极性溶剂的增加可能导致无法有效地提取非极性植物甾醇。
氯仿-甲醇,如Bligh-Dyer法和Folch法可提取所有种类的植物甾醇,然后经酸或碱水解形成游离的植物甾醇。
酸或酶(糖基化酶)水解SG和ASG中的糖苷键,将其转化为FS。
酸水解条件为利用0.5 ~ 3 mol/L的盐酸在70 ~ 100℃加热或回流和振荡。
碱性水解,也称皂化,用1 ~ 2.5 mol/L氢氧化钠或氢氧化钾的乙醇或甲醇溶液水解甘油三酯、SE、HSE和ASG中的羧酸酯键,从而将SE和HSE转化为FS,而如果存在ASG只会转化为SG。
接着液-液萃取用水或盐溶液和非极性溶剂去除脂肪酸皂和其他极性成分,而FS和其他非极性脂类称为不皂化物,则保留在有机相,植物甾醇是不皂化物的主要成分,需要进一步分离方可得到4,4-二甲基甾醇。

薄层色谱(TLC)或固相萃取(SPE)可用于进一步分离不同种类的植物甾醇。
美国油脂化学家学会(AOCS)方法Ch 6–91推荐使用TLC法从其他脂质和植物甾醇类化合物(4-单甲基甾醇和4-无甲基甾醇)中分离出4,4-二甲基甾醇。
传统的TLC法分离4,4-二甲基甾醇存在制备量少、回收率低、耗时长等缺点。
Azadmard-Damirchi等[22,23]利用SPE法从榛子油和橄榄油不皂化物(4,4-二甲基甾醇、4-单甲基甾醇和4-无甲基甾醇)中分离富集4,4-二甲基甾醇。
SPE法特点是萃取速度快、节省溶剂,但上样量少且萃取小柱价格高。
TLC和SPE两种分离方法制备量少。
因此,上述两种分离方法主要应用于分析研究。
Li等采用正相制备高效液相色谱法(P-HPLC)从油茶、芥菜和微孔草三种种子油不皂化物(烃类化合物、4,4-二甲基甾醇、4-甲基甾醇和4-无甲基甾醇)中分离出4,4-二甲基甾醇,P-HPLC法分辨率高,但成本高、费时。
Liu等利用高效逆流色谱法(HPCCC)从米糠油中分离4,4-二甲基甾醇阿魏酸酯(环阿屯醇阿魏酸酯和24-亚甲基环木菠萝烷醇阿魏酸酯单体)。
总的来说,正相高效液相色谱柱,如使用硅胶柱或二醇柱结合非极性溶剂洗脱,用于不同种类植物甾醇的分离,反相高效液相色谱柱则用于单体化合物的分离。
Lee等利用结晶-水解法从γ-谷维素中分离4,4-二甲基甾醇(环阿屯醇和24-亚甲基环木菠萝烷醇的混合物),可大规模生产。
而在前期预实验中发现混合游离甾醇采用相同的结晶方法,产物为4-无甲基甾醇,而不是4,4-二甲基甾醇,母液继续结晶,得到的4,4-二甲基甾醇纯度提高并不明显。
因此,从混合游离甾醇中分离富集4,4-二甲基甾醇有待进一步研究。

气相色谱法(GC)是鉴定和定量分析4,4-二甲基甾醇单体和总4,4-二甲基甾醇的常用手段,一般需要经过皂化和衍生化,生成三甲基硅基(TMS)醚或乙酸酯。
尽管衍生化不是必须的,但衍生化提高了4,4-二甲基甾醇的挥发性、峰形和响应因子,也有助于防止热降解。
常用的GC检测器为火焰离子检测器或质谱检测器。
高效液相色谱(HPLC)法被应用于鉴定和定量分析不同4,4-二甲基甾醇类别和4,4-二甲基甾醇单体。
HPLC分析的优势在于4,4-二甲基甾醇可以以游离或缀合物形式进行分析,不需要进行皂化和衍生化,通常采用示差折光(RID)或蒸发光散射检测器(ELSD),也可采用紫外(UV)或二极管阵列检测器(DAD)。

与GC分析一样,HPLC很难分离同分异构体或密切相关的游离4,4-二甲基甾醇和缀合物。
高效液相色谱-质谱联用技术的发展有助于4,4-二甲基甾醇的准确鉴定和定量,特别是有助于各种4,4-二甲基甾醇缀合物分子的鉴定。
我国居民每日膳食中植物甾醇的摄入量为257.7 ~ 473.7 mg,其中4,4-二甲基甾醇的摄入量为45.5 ~ 69.3 mg之间,与西方饮食中植物甾醇的膳食摄入量约300 mg基本一致。
4,4-二甲基甾醇主要以脂肪酸酯、羟基肉桂酸酯和糖苷的形式存在。
在胃肠道内,所有4,4-二甲基甾醇酯的酯键都被特定的酶水解形成游离的4,4-二甲基甾醇。
游离的4,4-二甲基甾醇随后进入混合胶束中,通过NPC1L1受体从混合胶束中被肠上皮细胞吸收。

4,4-二甲基甾醇被肠细胞吸收后,由于4,4-二甲基甾醇是肠道酰基辅酶A胆固醇酰基转移酶(ACAT)的不良底物,导致4,4-二甲基甾醇不易酯化,并在细胞内保持游离形式,其代谢与胆固醇不同。
因此,游离的4,4-二甲基甾醇不能有效地融入乳糜微粒。
相反,大多数游离4,4-二甲基甾醇通过ATP驱动的转运体异质二聚体ABCG5/G8排泄回肠腔,造成4,4-二甲基甾醇的肠道净吸收非常低。
进入循环的少量4,4-二甲基甾醇被肝脏迅速吸收,并通过肝脏ABCG5/G8分泌到胆汁中,导致血浆中4,4-二甲基甾醇浓度极低。
虽然4,4-二甲基甾醇吸收低,但增加摄入量会增加血浆中4,4-二甲基甾醇浓度,肝脏中4,4-二甲基甾醇水平亦会增加。
4,4-二甲基甾醇不是内源性合成的,所以在体内发现的4,4-二甲基甾醇分子均来自于饮食。
4,4-二甲基甾醇也会进入其他外周组织,包括血管壁、肺、大脑和母乳。
4,4-二甲基甾醇进入了血液循环这一点越来越受到人们的重视。
尽管与胆固醇相比,4,4-二甲基甾醇循环浓度非常低,但会被不同的组织吸收,可影响各种病理或生理过程。
如4,4-二甲基甾醇从肠腔进入循环的过程中,可干扰所有类型的免疫细胞。
4,4-二甲基甾醇在肝脏中代谢为C21胆汁酸,而不是正常的哺乳动物C24胆汁酸。
4,4-二甲基甾醇大部分很难被吸收,并通过粪便不加修饰地排出体外。

碳水化合物消化酶,尤其是α-淀粉酶和α-葡萄糖苷酶,在消化系统催化淀粉水解成葡萄糖,进入血液循环,导致2型糖尿病患者餐后高血糖。
因此,抑制碳水化合物消化酶是减少膳食碳水化合物摄入、抑制餐后高血糖,改善糖尿病症状的一种有效策略。
Sobhy等发现γ-谷维素(4-无甲基甾醇和4,4-二甲基甾醇的阿魏酸酯)、豆甾醇和β-谷甾醇对α-淀粉酶和α-葡萄糖苷酶有抑制作用。
另有研究发现阿魏酸亦可显著抑制α-淀粉酶和α-葡萄糖苷酶活性。
因此,无法判断γ-谷维素的抑制作用是由植物甾醇还是阿魏酸导致的。
Pujirahayu等发现4,4-二甲基甾醇(环阿屯醇)非竞争性抑制α-葡萄糖苷酶。
由此可见,4,4-二甲基甾醇和4-无甲基甾醇均有抑制活性。
虽然两者的半数抑制浓度(IC50)在文献中均有报道,但是不同溶剂体系无法对比。
因此,4,4-二甲基甾醇对消化酶的抑制作用是否优于4-无甲基甾醇有待进一步研究。


